PREMESSA
Il diabete è divenuto la causa più frequente di insufficienza renale terminale richiedente un trattamento sostitutivo negli USA (40% dei nuovi ingressi in dialisi).
In Europa rappresenta circa il 20% dei nuovi ingressi.
In Italia la percentuale di diabetici che entrano annualmente in dialisi varia dal 12 al 19% a seconda delle Regioni.
Sia il rischio di nefropatia che la rapidità di progressione verso l’insufficienza renale sono simili (20-30%) per il diabete tipo 1 e 2.
Alcuni autori hanno definito l’ESRD nel diabetico (soprattutto nel diabete tipo 2) una catastrofe medica di dimensioni mondiali.
La nefropatia diabetica si associa ad un netto aumento del rischio di morte (per aumento del rischio cardiovascolare) ancor prima della comparsa di ESRD: dopo l’ingresso in dialisi il rischio aumenta ulteriormente.
La sopravvivenza in trattamento dialitico è significativamente peggiore per i diabetici tipo 2, in cui già al momento dell’ingresso in dialisi, sono presenti importanti fattori di comorbidità cardiovascolare.
NEFROPATIA DIABETICA
La nefropatia è l’espressione a livello renale del danno diffuso a tutte le piccole arterie dell’organismo, causato dalla mancata correzione dell’iperglicemia.
Le piccole arterie renali hanno una funzione molto particolare: all’interno dei glomeruli, danno luogo ad una fitta rete di capillari, il glomerulo, tramite il quale filtrano il sangue eliminando le sostanze di scarto prodotte da tutte le cellule dell’organismo durante il loro funzionamento.
Queste sostanze vengono eliminate insieme con un’adeguata quantità di acqua, con la quale vanno a costituire l’urina.
Affinché la filtrazione del sangue avvenga correttamente, è necessario che le pareti dei glomeruli e quindi delle membrane filtranti siano indenni.
L’eccessiva glicazione (reazione tra uno zucchero ed una proteina) delle proteine che compongono queste membrane, causata dall’iperglicemia cronica, altera la loro struttura: in una prima fase i pori si allargano e le membrane lasciano passare più del dovuto, si ha un’aumentata permeabilità; in seconda fase, la loro permeabilità diminuisce sempre di più, fino a cessare quasi del tutto a causa di irrigidimento ed ispessimento. Nella sorveglianza della nefropatia diabetica ha grande importanza il riconoscimento della microalbuminuria, ossia la concentrazione urinaria di albumina superiore alla norma (ma inferiore ai valori osservabili nelle glomerulopatie franche). La microalbuminuria è caratteristica della nefropatia diabetica in una fase abbastanza precoce e generalmente reversibile, cioè quando abbiamo un aumento della permeabilità dei pori tale che le proteine plasmatiche riescono ad essere filtrate.
La nefropatia diabetica è la causa principale di insufficienza renale cronica ed una delle cause principali di morbilità e mortalità correlata al diabete mellito.
La nefropatia diabetica è una sindrome clinica caratterizzata da albuminuria persistente, lento e graduale declino della funzione renale, ipertensione arteriosa ed alto rischio di malattia cardiovascolare.
La forma iniziale o incipiente è diagnosticata sulla presenza della microalbuminuria persistente in assenza di infezioni delle vie urinarie, anomalie urinarie o scompenso cardiaco.
La forma manifesta o conclamata è diagnosticata in presenza di macroalbuminuria, ipertensione arteriosa e graduale declino della funzione renale.
Una escrezione urinaria di albumina (AER) di 20-200 µg/min viene definita microalbuminuria, se superiore a 200 µg/min viene definita macroalbuminuria, in condizioni normali l’AER è < 20 µg/min. La patogenesi della nefropatia diabetica è correlata all’iperglicemia cronica, i meccanismi attraverso i quali l’iperglicemia cronica determina la malattia renale, anche se non completamente definiti, sono i seguenti: interazione di fattori solubili (fattori di crescita, angiotensina II, endotelina), alterazioni emodinamiche nel microcircolo renale (iperfiltrazione glomerulare, aumentata pressione idrostatica trans-capillare glomerulare) e modificazioni strutturali nel glomerulo (aumento della matrice extracellulare, ispessimento della membrana basale, espansione mesangiale, fibrosi. Descritta per la prima volta nel 1963 da Kimmelstiel e Wilson, fu identificata nella glomerulosclerosi nodulare.
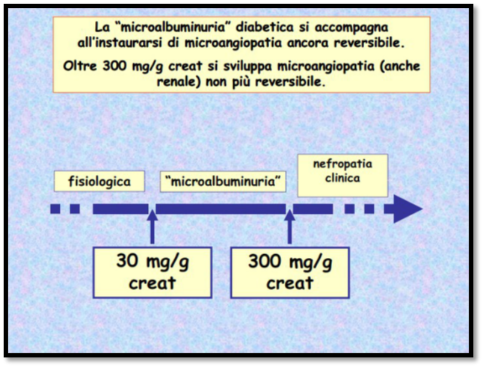
Fig.1 valori di creatinina legate a microalbuminuria
I PRODOTTI DELLA GLICAZIONE
Gli AGE, dall’inglese “Advanced Glycation End-products” sono dei composti derivati dallo zucchero creati nell’organismo. Mangiare alcuni cibi cotti ad alte temperature aumenta i depositi di AGE nelle arterie e ciò può portare all’insulino-resistenza, al diabete e al danno renale.
Si trovano per esempio sulle superfici dorate o abbrustolite di cibi fritti o grigliati, oppure sul pane tostato. Oltre al colore, gli AGE conferiscono agli alimenti cotti anche sapore e aroma, tipici quelli dei prodotti da forno, dei derivati del latte, della carne e del pesce. Con la dieta attuale, ed in particolare quella di tipo occidentale, consumiamo più AGE di quanto accadeva in passato.
La glicazione consiste in una reazione tra uno zucchero (glucosio, fruttosio, ecc.) e una proteina o un lipide (grasso).
Nel nostro organismo avvengono numerose reazioni di questo tipo in maniera controllata consentendo alla molecola che subisce la glicazione, di svolgere la sua funzione.
Purtroppo in determinate condizioni la glicazione può avvenire casualmente, senza controllo, portando le molecole a non funzionare correttamente.
L’esempio più noto di AGE per le persone con diabete è l’emoglobina glicata (HbA1c), sostanza che deriva appunto dalla glicazione avanzata dell’emoglobina. Il corpo li produce ma in modo molto più lento.
Molte reazioni di glicazione servono per il corretto funzionamento di alcune molecole ma in condizioni di elevate concentrazioni di zuccheri, come il glucosio nel sangue (iperglicemia) nel diabete, le reazioni di glicazione diventano incontrollabili. Il glucosio reagisce con le proteine presenti nel sangue e nei tessuti generando molecole biologicamente inattive, gli AGE appunto, che in quantità elevate in circolo sono tossiche e dannose perché possono provocare infiammazioni e ossidazioni nocive per la nostra salute.
Le evidenze scientifiche più attuali stanno portando a correlare la presenza di AGE totali nell’organismo con numerosi processi infiammatori, patologie dismetaboliche, aterosclerosi e insufficienza renale nello specifico.
Gli studi dimostrano che all’aumentare degli AGE assunti con la dieta aumentano i livelli di queste sostanze nel circolo sanguigno, aggravando il rischio di insorgenza di alcune malattie e/o aumentando il rischio di complicanze in caso di patologia già in essere, come accade per le complicanze del diabete, soprattutto quelle di tipo cardiovascolare e renale.
Gli AGE, una volta assorbiti, tendono ad accumularsi nei tessuti e a danneggiarli.
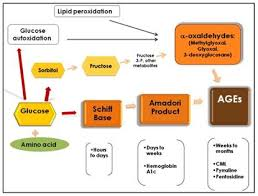
Fig. 2 – Formazione di AGE
CORRELAZIONE TRA PRODOTTI DELLA GLICAZIONE E AVANZAMENTO DELLA PATOLOGIA
Nonostante la produzione di ROS si confermi il minimo comune denominatore nella patofisiologia delle complicanze microvascolari del diabete, l’eccesso di formazione di AGE (e dei processi biochimici da essi innescati) sembra svolgere un ruolo predominante nei processi di stress ossidativo, anche in considerazione dello sviluppo di prodotti con proprietà di scavenger degli AGE. Alla base della fisiopatologia delle complicanze croniche, è che il danno microvascolare sia il risultato di un meccanismo non organo-specifico, con una patogenesi sistemica che conduce a un aumento del rischio macrovascolare a lungo termine.
Le principali vie di danno tessutale causato dagli AGE derivano dagli effetti della glicazione intracellulare, dalla formazione cross-link con proteine tessutali e dall’interazione con i recettori degli AGE (RAGE).
L’accumulo intracellulare di AGE altera le proteine citoplasmatiche e nucleari, comprese le proteine coinvolte nella regolazione della trascrizione genica.
Il secondo meccanismo comprende la formazione di cross-link con molecole strutturali, quali il collagene ma non solo, con conseguente alterazione delle proprietà chimico-fisiche e della funzionalità (tipiche delle complicanze croniche del diabete), quali l’ispessimento della membrana basale con una resistenza alla digestione proteolitica. Infine, l’interazione AGE-RAGE innesca un signalling intracellulare, compreso il fattore-kB (NF-kB) di attivazione nucleare, con aumento di citochine pro-infiammatorie ed espressione di molecole di adesione, induzione di stress ossidativo e un aumento di ROS a livello citoplasmatico. I pazienti con nefropatia diabetica presentato una duplice forma di danno, vale a dire un aumento della formazione di AGE sierici e loro ridotta clearance renale. Data la complessa cito-architettura del glomerulo renale, numerosi meccanismi di danno sono stati ipotizzati da parte degli AGE a questo livello.
La glicazione del collagene di tipo IV e della laminina, per esempio, altera la funzione di queste proteine, provocando un aumento della permeabilità vascolare all’albumina.
D’altra parte, i cambiamenti strutturali in altre proteine della matrice extracellulare indotti dagli AGE pregiudicano la loro degradazione da parte delle metallo-proteasi, portando a un ispessimento della membrana basale, un aspetto istopatologico ampiamente noto nella nefropatia diabetica, fin dagli stadi iniziali.
Un altro bersaglio della glicazione non enzimatica nel rene è il mesangio, dove le alterazioni indotte dagli AGE (aumento dell’apoptosi dei periciti e dell’espressione del VEGF) causano iperfiltrazione glomerulare, una disfunzione renale caratteristica delle fasi iniziali della malattia diabetica; d’altra parte si è dimostrato che pazienti con diabete di tipo 2 con microalbuminuria presentavano livelli sierici di AGE più elevati rispetto a pazienti senza microalbuminuria, anche con funzione renale normale. I RAGE infatti sono espressi a livello dei podociti glomerulari e delle cellule tubulari. La loro interazione con gli AGE promuove quindi modifiche patogenetiche in queste cellule (principalmente attraverso l’aumentata produzione di ROS), contribuendo alla glomerulosclerosi e fibrosi tubulo-interstiziale.

Fig. 3 formazione AGE dalla glicazione
INFIAMMAZIONE E DANNO D’ORGANO
Alcuni fattori, tra i quali l’iperglicemia, l’ipertensione arteriosa e un alterato trasporto cellulare di sodio, sommati ad un’innata predisposizione genetica, sono i principali elementi che favoriscono l’insorgenza della nefropatia. Ma anche diabete, dislipidemia, obesità e sindrome metabolica, nonché ulteriori fattori di rischio non tradizionali, possono danneggiare direttamente il rene e promuovendo l’aterogenesi intrarenale.
Le prove indicano che un aumento dello stress ossidativo e dell’infiammazione possono mediare la maggior parte degli effetti dei fattori di rischio sul rene.
I pazienti con microalbuminuria, specialmente nel diabete, possono progredire lungo il continuum renale fino alla malattia renale cronica (CKD) (indicata da macroalbuminuria o proteinuria), aumento della concentrazione sierica di creatinina e riduzione della velocità di filtrazione glomerulare.
La microalbuminuria è ora riconosciuta come un marcatore importante non solo per la malattia renale, ma soprattutto per il rischio cardiovascolare. In considerazione di questo studi clinici hanno dimostrato una relazione tra lo stress ossidativo e i biomarcatori infiammatori e alcuni studi indicano una correlazione inversa dei biomarcatori dello stress ossidativo, valutata dall’8-isoprostaglandina F2 alfa, con un tasso di filtrazione glomerulare stimato (e-GFR).
Inoltre, è stato dimostrato che le concentrazioni plasmatiche di proteina C reattiva ad alta sensibilità (PCR-HS) sono aumentate e correlate alla massa ventricolare sinistra in soggetti con insufficienza renale cronica che hanno ipertrofia ventricolare sinistra. Inoltre, è stato dimostrato che indici surrogati di aterosclerosi come lo spessore intima-media e la velocità dell’onda del polso aortica sono correlati alle concentrazioni plasmatiche di marker di attivazione endoteliale, infiammazione e fibrosi in pazienti con diversi stadi di CKD. In conclusione, le prove attuali supportano un ruolo centrale per l’infiammazione in tutte le fasi del processo aterosclerotico.
D’altra parte, nell’ipertensione arteriosa i dati sperimentali e clinici suggeriscono una possibile interazione di molecole infiammatorie con marcatori sia di stress ossidativo che di attivazione endoteliale. L’identificazione di nuovi biomarcatori e fattori di rischio cardiovascolare è necessaria per la valutazione prognostica, la prevenzione cardiovascolare e renale e il rallentamento del declino della funzione renale. Anche l’ Endotelina-1 e F2-isoprostane si riferiscono e predicono la disfunzione renale nei pazienti ipertesi. Si è ipotizzato che nei pazienti ipertesi (HT), lo stress ossidativo, misurato come 8-ISO-prostaglandina F2alpha (8-ISO-PGF2alpha), dovrebbe aumentare il parallelismo diminuendo la funzione renale e dovrebbe correlarsi con il tasso di filtrazione glomerulare stimato (eGFR). In uno studio quindi è stato dimostrato che in 626 pazienti ipertesi con funzionalità renale che vanno dalle fasi 1 a 5 e 100 controlli sani, livelli plasmatici di 8-ISO-PGF2alpha, proteina C-reattiva ad alta sensibilità, del fattore di crescita trasformante beta (TGF-β) e sono stati misurati l’endotelina-1 (ET-1). Il GFR è stato stimato dalla modifica della dieta nell’equazione di studio sulla malattia renale con risultati che sono una chiara evidenza di una correlazione forte e negativa sia dello stress ossidativo che dell’ET-1 con gli stadi della funzione renale nell’HT. ET-1 e 8-isoprostane sono predittivi di eGFR.
Trattamento dietetico
Il bilancio delle evidenze è dato dall’ipotesi di un effetto benefico della restrizione proteica anche nelle fasi più iniziali del coinvolgimento renale: una modesta restrizione dell’apporto proteico si associa a riduzione della microalbuminuria in diabetici tipo 2.
Quando compaia una nefropatia conclamata ed una riduzione del GFR la restrizione proteica con apporto controllato di fosforo può rallentare la progressione verso l’ESRD e prevenire/controllare le complicanze proprie dell’insufficienza (Iperparatiroidismo secondario, acidosi metabolica, dislipidemia ecc.). È necessario porre molta attenzione al rischio di malnutrizione proteico calorica a cui questi pazienti possono andare incontro.
Pertanto, in tali pazienti, è importante mantenere inalterata la massa magra e ciò potrebbe essere possibile bilanciando un piano alimentare con carichi proteici in diversa percentuale di settimana in settimana dopo valutazione con esame bioimpedenziometrico (BIA) per lavorare in modo certosino bilanciando tutti gli elettroliti plasmatici. Di rilevante importanza nel trattamento dietoterapico la cura del microbiota intestinale utile supporto di correlazione con la patologia.
CONCLUSIONI
L’eccesso dei prodotti di glicazione avanzata (AGE) è uno dei meccanismi più importanti coinvolti nella fisiopatologia delle complicanze croniche del diabete. In particolare alla luce dei nuovi meccanismi biochimici per la nefropatia. La relazione tra gli AGE e la cosiddetta “memoria metabolica”. Come dimostrato da recenti studi, gli AGE hanno diversi target sia intra- sia extracellulari, e per tale motivo è ragionevole ipotizzarli come un “ponte” tra danno intracellulare e danno extracellulare, nella progressione delle complicanze croniche. A partire da tale ipotesi, la fisiopatologia degli AGE potrebbe aiutare a spiegare il legame osservato in molti studi clinici tra malattia micro- e macrovascolare, ponendosi come uno dei meccanismi alla base della memoria metabolica. Un approccio efficace per la prevenzione e il trattamento delle complicanze microvascolari dovrebbe quindi concentrarsi non solo sul controllo glicemico, ma anche sulla riduzione dei fattori legati allo stress glico-ossidativo.
La terapia dietetica rappresenta uno strumento importante nella gestione della malattia renale cronica (CKD), principalmente attraverso la riduzione equilibrata dell’apporto proteico mirato a dare ai nefroni rimanenti nei reni danneggiati un “riposo funzionale”. L’obiettivo della “dieta a basso carico proteico” per gestire in modo conservativo l’accumulo di prodotti di scarto proteico e ritardare la necessità di un trattamento di dialisi è stato ostacolato dalla paura della perdita di massa proteica. Si raccomanda l’implementazione della dieta a basso contenuto proteico come regime dietetico adeguato al fine di ritardare il declino della GFR e l’inizio della dialisi. Un minor accumulo di prodotti di scarto proteico allevia le manifestazioni cliniche di uremia anche nella fase molto avanzata della CKD, e infatti la dieta a carico proteico controllato può essere utilizzata efficacemente per ritardare l’inizio della terapia dialitica. Dato che l’inizio precoce della terapia dialitica non sembra offrire alcun beneficio in termini di sopravvivenza gli approcci conservativi sono senz’altro giustificati nella gestione dei pazienti con CKD avanzata.
Pertanto, dovrebbe essere considerato un approccio multidirezionale che includa un approccio dietetico gestito con competenza e razionalità per garantire il miglior risultato nei pazienti con CKD.
Non ultima, la raccomandazione di agire sulla prevenzione di patologie come ipertensione, obesità, sindrome metabolica e dislipidemie per evitare l’insorgenza dell’infiammazione di basso grado e di conseguenza il danno d’organo.
Fonti
Koschinsky T, He CJ, Mitsuhashi T, Bucala R, Liu C, Buenting C, Heitmann K, & Vlassara H (1997). Orally absorbed reactive glycation products (glycotoxins): an environmental risk factor in diabetic nephropathy. Proceedings of the National Academy of Sciences of the United States of America, 94 (12), 6474-9
Prodotti finali di glicazione avanzata negli alimenti e una guida pratica alla loro riduzione nella dieta Jaime Uribarri , MD, Sandra Woodruff , RD, Susan Goodman , RD, Weijing Cai , MD, Xue Chen , MD, Renata Pyzik , MA, MS, Angie Yong MPH, Gary E. Striker , MD, Helen Vlassara , MD ,
Giovannetti S., Maggiore Q.A. (1963) “Low-Nitrogen Diet with protein synthesis in normal and uramemic subjects”. J Lab Clin Med 62:231-246.
Ruolo dei prodotti di glicazione avanzata nelle complicanze microvascolari del diabete di tipo 2: “attori protagonisti”nella memoria metabolica Chilelli NC, Piarulli F, Sartore G, Lapolla A Dipartimento di Medicina (DIMED), UOC Diabetologia e Dietetica, ULSS 16, Università degli Studi di Padova, Padova
M Guarneri , S Cottone G Ital Nefrol. Lug-ago 2009; 26 Suppl 46: 8-13. Infiammazione, stress ossidativo e funzione renale nell’ipertensione arteriosa-G Cerasola 1,
Nephrol Dial Transplant. Febbraio 2009; 24 (2): 497-503. doi: 10.1093 / ndt / gfn489. Epub 2008 4 settembre.
diabete-rivistamedia.it/wp-content/uploads/2015/04/RivMedia3_03.pdf#page=23






