Cari Amici e Colleghi oggi vorrei condividere con Voi uno studio condotto durante il mio percorso universitario molto interessante che vede come protagonista un nostro alleato quotidiano il Caffè.
In questo studio viene dimostrato il suo effetto benefico a livello molecolare.BUONA LETTURA
CAFFE’ E CARCINOMA EPATOCELLULARE
Il caffè viene consumato a livello mondiale e pochi sono gli effetti collaterali legati alla sua assunzione. Negli studi effettuati in vari paesi l’assunzione di caffè è stata correlata alle attività nel siero degli enzimi gamma-glutammil-transferasi e alanina-amino-transferasi. Inoltre , i risultati epidemiologici esaminati indicano che il consumo di caffè è correlato alla cirrosi epatica; tuttavia non è possibile dimostrare l’esistenza di un rapporto causa-effetto tra caffè e prevenzione della lesione epatica.
I modelli animali e le colture cellulari indicano che terpeni come kahweol e cafestol ( componenti del caffè) possono funzionare come agenti inibenti modulando diversi enzimi coinvolti nella disintossicazione cancerogena; queste molecole alterano anche il metabolismo xeno-tossico inducendo gli enzimi glutatione-s-transferasi ed inibendo n-acetil-transferasi. L’assunzione del caffè è stata associata alla riduzione del rischio di lesione epatica e cirrosi, step di notevole importanza nel processo dell’epatocancerogenesi. Il beneficio che produce il consumo di caffè sul cancro epatico può essere attribuito alla sua relazione inversa con la cirrosi,nonostante non sia clinicamente ben evidenziata l’associazione con la cirrosi stessa. L’attività salutare legata al consumo del caffè si esplica,dunque, sull’attività degli enzimi epatici, della patogenesi della cirrosi e del carcinoma epatocellulare. E’ possibile proporre esperimenti con modelli animali inficiati da danno epatico per testare l’effetto del caffè e\o di componenti isolati della bevanda, non solo per valutare il possibile ruolo causale del caffè ma anche il suo meccanismo d’azione. Inoltre,sono anche necessari studi clinici prospettici in doppio cieco.
Apprezzato per il suo aroma e sapore, il caffè ha occupato nella società un posto preponderante per almeno 1200 anni ed è su ampia scala una delle bevande più popolari e più consumate nel mondo. Il caffè è costituito da migliaia di componenti diversi, come carboidrati,lipidi,vitamine,alcaloidi,molecole azotate e componenti fenolici. Sono stati condotti molti studi sulle proprietà benefiche del caffè sugli esseri umani . Vi sono, tuttavia, ipotesi risultate dalle osservazioni epidemiologiche circa gli effetti deleteri della caffeina. In passato tali effetti erano probabilmente aggravati da alte assunzioni di caffè in associazione al fumo di sigaretta e alla sedentarietà . Recentemente il consumo di caffè è stato correlato alla riduzione di varie malattie croniche, in particolare sono stati studiati gli effetti benefici e deleteri del caffè in correlazione a malattie epatiche sia in modelli animali sia in essere umani. Vi sono evidenze rilevanti circa l’ effetto potenzialmente favorevole del caffè sulle malattie epatiche studiate negli ultimi 20 anni. Le evidenze benefiche spaziano dagli effetti positivi sugli enzimi epatici alla cirrosi ed al carcinoma epatocellulare.(hcc) Le conclusioni a cui tali studi sono giunti derivano dalle osservazioni epidemiologiche eseguite mediante esperimenti sui modelli animali con lesione epatica.
[ La Vecchia CL.2005]
CAFFE’ ED ENZIMI EPATICI
Il consumo del caffè è stato associato ad una riduzione nell’espressione dell’enzima gamma-glutamil-transferasi (GGT). Questa relazione è particolarmente evidente nei soggetti a rischio, soprattutto nei soggetti che assumono elevate concentrazioni di etanolo.
Alanina-amino-transferasi (ALT) è un enzima citosolico degli epatociti ed è un marcatore di necrosi epatica se aumenta nel siero. In Italia e in Giappone, il danno epatico era anche correlato al consumo di caffè. Recentemente, uno studio a sezione trasversale condotto in circa 6000 adulti ad alto rischio di danni epatici da varie eziologie ha riscontrato che il consumo di caffeina riduce il rischio di elevata attività dell’enzima alanina- amino –transferasi. È stato riscontrato che la lesione epatica inibisce il metabolismo della caffeina aumentando la possibilità che le persone con patologia epatica bevano meno caffè perche più probabile che si verifichino effetti negativi indotti dalla caffeina. D’altronde ,la relazione tra l’attività del siero ALT ed il consumo di caffè era la stessa in soggetti con funzione epatica compromessa o normale. La possibilità per la patologia epatica di danneggiare la liberazione di caffeina indicava l’importanza di distinguere ex bevitori di caffè e non bevitori in futuri studi epidemiologici. [Ruhl CE,Jeverhart JE.2005]
CAFFE’ E FIRROSI\CIRROSI
CIRROSI\FIBROSI
La lesione cronica al fegato può causare fibrosi epatica caratterizzata da un accumulo di matrice extracellulare delle proteine (ECM):
le cause principali della fibrosi epatica\ cirrosi includono epatiti croniche delle infezioni del virus COB (HCV e HBV),abuso d’alcol,parassiti e steatoepatite non alcoliche (NASH). L ‘accumulo delle proteine ECM falsa l’ architettura epatica del fegato producendo cicatrici fibrose e lo sviluppo successivo di noduli di epatociti rigeneranti che inducono la cirrosi. La cirrosi include la disfunzione degli epatociti e l ‘aumentata resistenza intraepatica del flusso di sangue comportano l’insufficienza epatica e l’ ipertensione portale rispettivamente.[Bataller R,Brenner DA.2005]
DEI FATTORI COINVOLTI NELLA FIBROSI.
Una grande quantità di prove mostra che il processo epatico fibrogenico è regolato altamente da TGF-beta1(fattore di crescita trasformante-beta1). In aggiunta alle cellule epatiche stellate (HSC) che sono indotte dal TGF-beta per differenziarsi in mio-fibroblasti e per produrre importanti aumenti delle proteine ECM , gli epatociti sono ora riconosciuti come cellule importanti che partecipano attivamente nel processo fibrogenico. Transizioni di epatociti di fibroblasti come cellule indotte dal TGF-beta mostrano l importanza patogenetica di queste cellule in aggiunta al HSC. È stato riportato che gli epatociti sintetizzano CTGF (fattore di crescita del tessuto connettivo) in cultura e in fegato danneggiato e che CTGF è sopraregolato dal TGF-beta e che gli epatociti sono probabilmente la risorsa cellulare principale del CTFG nel fegato. Allora il CTGF è riconosciuto come un importante modulatore a valle del TGF-beta, amplificando l’ azione profibrogenica di queste citochine nel fegato e negli altri tessuti. Il ruolo cruciale del CTGF nella fibrogenesi è mostrato dall’importante sopraregolazione nei fegati fibrotici. Inoltre, è degno di nota che l ‘utilizzo di un piccolo interferente RNA(siRNA) per attenuare CTGF conduce alla prevenzione o decremento di fibrosi sperimentale. Pertanto, CTGF appare come un obiettivo interessante per combattere le fibrosi e le cirrosi.[ Li G, Xie Q, Shi Y, Li D, Shang M, Jiang S, et al.2006]

fig.1 La via metabolica di segnalazione della superfamiglia TGFb. Legandosi ai ligandi della superfamiglia, TGF-b innesca la formazione di un complesso eteromerico di recettori chinasi serina/treonina. Il recettore chinasico di tipo II fosforila e attiva il recettore di tipo I che a sua volta fosforila e attiva R-Smad. L’attivazione del recettore di tipo I fosforila recettori-specifici Smad,i quali, per il pathway TGFb, include Smad2 e Smad3. Questo processo puo’ essere inibito da Smad7. Fosfo-Smad2 e 3 formano complessi con il co-Smad (Smad 4) traslocando nel nucleo,dove possono interagire con altri fattori di trascrizione o coattivatori e corepressori per regolare la trascrizione.
LA CAFFEINA DIMINUISCE TGF-beta
Gli studi dimostrano che l’adenosina ciclica monofosfato(cAMP) è stata identificata come un inibitore dell’induzione CTGF dal TGF-beta e la caffeina e altre metilxantine sono ben conosciute per elevare i livelli intracellulari cAMP inibendo l’attività della fosfodiesterasi. Tutte queste informazioni forniscono l’evidenza molecolare che il caffè,in tale caso la caffeina,può essere utilizzata per combattere la fibrosi e la cirrosi. Gressner et al scoprirono l’effetto benefico della caffeina sul CTGF come modulatore profibrogenico delle azioni TFG-beta riscontrando che la caffeina inibisce l’ espressione del CTGF nelle cellule del fegato inducendo la degradazione del proteasoma del segnale TGF-beta e del mediatore SMAD2,dell’inibizione della fosforilazione di SMAD 3 e 1 e della sopraregolazione dei perossisomi proliferatori attivati dal recettore gamma(PPARY) ,espressione del suo recettore. Pertanto,la caffeina a lungo termine appare come utilizzo interessante per prove antifibrotiche in malattie croniche del fegato in animali ed umani.
[ Gressner OA.2008]
SVILUPPO DI CIRROSI EPATICA E CAFFE’
I dati evidenziati forniscono l ‘evidenza molecolare dei possibili effetti benefici del caffè nello sviluppo delle fibrosi e cirrosi epatiche. L ‘effetto del caffè sugli enzimi del fegato umano,precedentemente descritti,indicano anche il ruolo di questa bevanda nella lesione epatica a lungo termine. Alcuni studi hanno riscontrato il rischio di cirrosi nell ‘assunzione di caffè.
Nello studio prospettico condotto da Klatsky et altri,è stata mostrata la relazione tra caffè e cirrosi per la prima volta. Il solo consumo di caffè è stato correlato al rischio di cirrosi alcolica in persone che bevevano uno o più tazze al giorno ad 1\5 del rischio di quelli che non bevevano caffè. T.verdeland e Skurtveit monitoravano più di 50000 adulti in corso di screening per malattia cardiovascolare. Per 17 anni si sono verificate 4207 morti,53 di cirrosi. Questo studio fornisce l’evidenza di un ruolo favorevole del consumo della bevanda di caffè sul rischio di morte da cirrosi epatica; la mortalità è stata fortemente inferiore tra le persone che bevevano trenta e più tazze di caffè paragonate a persone che ne bevevano meno di due tazze. Questa relazione era valida per entrambi i gruppi , sia quelli con cirrosi alcolica, sia pazienti con cirrosi secondarie ad altri fattori. Corrado et Al. seguirono uno studio di 732 soggetti(274 casi e 458 controlli) e trovarono una relazione dose-risposta tra l’assunzione di caffè ed il rischio di cirrosi epatica con l’indice di probabilità (OR) per la cirrosi del fegato diminuito rispettivamente dall’ 1.0 degli astemi allo 0.47,0.23,0,21 e 0.16 per 1,2,3 o 4 tazze di caffè. Il ruolo della caffeina era anche valutato in altre bevande contenenti caffeina sullo sviluppo della cirrosi epatica. In modo interessante, a differenza del caffè,l’assunzione di caffeina nelle altre bevande non ha mostrato alcune relazione con la cirrosi,suggerendo che altre componenti di caffè possano giocare un ruolo nelle malattie del fegato. Tali osservazioni sono state successivamente confermate da studi caso-controllo con la morbosità di cirrosi epatica come evoluzione finale. Un’ ulteriore conferma della riduzione del rischio della cirrosi da consumo di caffè viene da uno studio confermato da Gallus et Al. ,che osservano che i bevitori presentavano in minor quantità la cirrosi. Questi risultati epidemiologici addizionati indicano che il consumo di caffè è proporzionale alla cirrosi epatica ; tuttavia non è possibile dimostrare un ruolo causale del caffè con la prevenzione nella lesione del fegato. Studi clinici prospettici controllati e ricerche sono necessarie prima di raggiungere una conclusione definitiva.
[ Gallus S.2001]
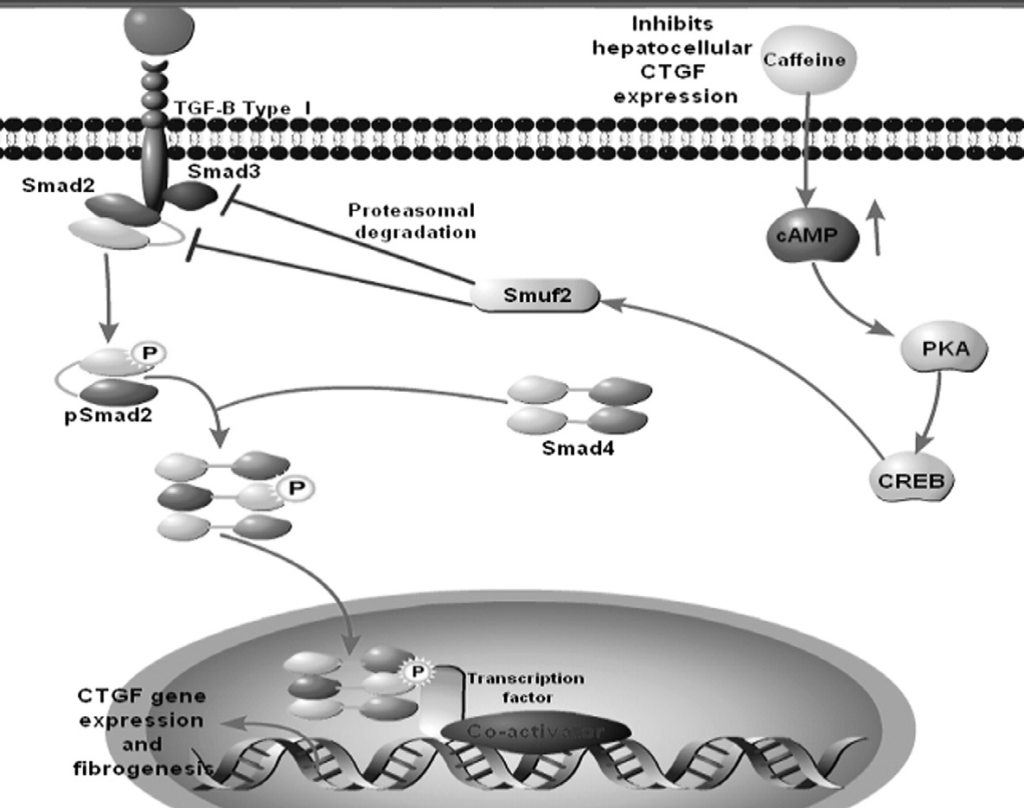
fig2. il modello per Tgfb induce l’espressione di CTGF negli epatociti e la successiva fibrogenesi. L’attivazione via intracellulare del dominio chinasico del recettore Alk5 innesca Smad2 ma non la fosforilazione di smad3 portando ad una traslocazione nucleare con il mediatore comune smad4 e la conseguente espressione di CTGF. Il pathway di segnalazione della caffeina mediata dalla soppressione di CTGF negli epatociti: la caffeina inibisce l’ espressione epatocellulare di CTGF attraverso un’elevata concentrazione di cAMP portando ad una degradazione dell effettore di TGFb Smad2 da parte di un’ubiquitina-ligasi Smurf2 che mostra alta sensibilità attraverso questo particolare Smad tanto quanto il complesso recettore TGFb. Inoltre si osserva un’inibizione della fosforilazione di Smad3 ma solo una piccola degradazione della proteina smad3 che è in contrasto a smad2.
POSSIBILE MECCANISMO ANTI-CANCEROGENO PER DITERPENOIDI
FASE 1-MECCANISMI INDIRETTI
L’attivazione di alcuni cancerogeni in fase 1 comportano la stimolazione dell’attività biologica di enzimi, che è un prerequisito fondamentale in questa fase per l’inizio della cancerogenesi.In tal modo gli enzimi attivatori rappresentano un ulteriore target della terapia anti-cancerogena. CHK sono indicati a funzionare in tale fase.
INIBIZIONE NELLA 1 ATTIVANDO L’ESPRESSONE DELL’ENZIMA
E’ stato dimostrato che un importante ruolo gioca la riduzione dell’ attivazione cancerogena nel C+K mediante l’inibizione della sintesi di dna mutato legato alla stimolazione di processi di detossificazione . Il trattamento a lungo termine con diete contenenti C+K diminuisce l ‘espressione epatica del citocromo P450 CYP3A2, i livelli di proteina sintetizzata ex novo e l ‘attività enzimatica risulta diminuita. Altri P450s erano alterati dai trattamenti C+K. Per esempio, l’espressione nell’uomodi P450 CYP2C11 era anche diminuita del 35% a 2300 ppm e 88% a 6200 pmm di C+K. Tali effetti sul CYP3A2 e CYP2C11 era confermati nel ratto, in colture di epatociti primari. Da quando CYP2C11 e CYP3A2 sono i maggiori responsabili P450s per la bioattivazione di AFB1(aflatossina B1) in AFBO nel ratto, è stato ipotizzato che una riduzione nell’espressione di questi geni può contribuire all’attività preventiva di C+K negli adulti AFB1-dna. Questi dati confermano un ruolo nella diminuzione in fase 1 dell’espressione dell’enzima negli effetti chemio protettivi di C+K contro la genotossicità AFB1.
[ Cavin C.1998]
INIBIZIONE DELLA FASE 1 DELLA ATTIVITA’ ENZIMATICA
Un’inibizione diretta dell’ attività enzimatica P450 senza nessun effetto sull’espressione proteica è un meccanismo in più della fase1 attraverso il quale i diterpeni del caffè possono agire. Per esempio C+K hanno mostrato di indurre l’ inibizione della attività P4501A1 nelle cellule del fegato che sono risultate caratterizzate dalla riduzione dell’ attivazione B(a)P (benzo (a) pirene, un pro cancerogeno, e del dna vincolante. Effetti inibitori simili sono stati trovati con CYP2B6 umano, nel P450 per la bioattivazione di AFB1. In più, è stato suggerito che riduzione di PhIP-dna addotti trovati in C+K ratti trattati coinvolge l’ inibizione di PhIP, enzimi attivanti CYP1A2 e n-acetiltransferasi (NA); L’effetto C+K è stato anche evidenziato nella riduzione dell’n-idrossilazione di 4-aminobifenile in vitro.
[ Hammons GJ.1999]
INDUZIONE DI FASE 2 ENZIMI DISINTOSSICANTI
È noto che la fase iniziale della neo-formazione tumorale consiste nella modifica permanente del Dna con metaboliti elettrofili o ossidanti derivati da agenti cancerogeni attivati. In fase 2 gli enzimi disintossicanti attivano, attraverso l’inibizione della formazione e\o stimolazione della disintossicazione, degli intermedi elettrofili o ossidanti che conferiscono un danno diminuito del Dna, bloccando inizialmente la modificazione del Dna stesso.
L’induzione di questi enzimi rappresenta un’ importante terapia anti –cancro. Primi studi indicarono che C+K inducevano l’attività del glutatione s-transferasi (GST) nel fegato del topo e nell’ intestino tenue. Da quando GST è utilizzato per disintossicare composti elettrofili attraverso l’interazione con il glutatione, questi dati conducono all’ipotesi che C+K può possedere le proprietà degli agenti bloccanti. Altri studi recenti confermano questa ipotesi e mostrano che gli effetti preventivi C+K possono essere mediati sia da un’ inibizione di bioattivazione che da una stimolazione di disintossicazione. Gli effetti di C+K sull’espressione di varie subunità GST sono stati studiati nel ratto. Gli effetti più impressionanti identificati sono la forte induzione dose-dipendente del GSTi, della subunità Yp e subunità alfa Yc2 (rGST A5) nel fegato, dell’ mRNA e dei livelli di proteina seguenti il trattamento a lungo termine con la dieta contenente C+K. Nel trattamento,C+K l’induzione mediata di GST-P avviene nel giro di pochi giorni. Inoltre è stato mostrato che l’aumentata espressione è dipendente dalle elevate concentrazioni di C+K nella dieta. In accordo con questo, i livelli dell’attività complessiva di GST, come misurati con clorodinitrobenzene (CDNB) sono aumentati di 2-3 volte durante un esposizione e a dieta di 10 giorni a 2000 ppm C+K, ma sono ritornati a livelli pretrattati di 10 giorni dopo la rimozione del trattamento della dieta.
Nei ratti nutriti con 0,2 C+Ksono state osservate forti crescite nel fegato e nei reni (2-3 volte come comparato ai controlli) . In più,relativamente agli effetti sull’espressione GST,C+K sono stati trovati ad interagire nella fase 2 degli enzimi metabolizzanti xeno-biotici come le attività UGT e NQ01 (chinino ossido reduttasi 1).
[ Huber WW.2008]
Concludendo possiamo affermare che vi è un grande numero di prove che supporta l’effetto favorevole di bevande contenenti caffè sulla funzionalità del fegato. Studi epidemiologici suggeriscono fortemente che bere 3 tazze di caffè riduce il rischio o la gravità del danno del fegato causato da una varietà di agenti eziologici. Tuttavia, gli studi meccanicistici indicano che non ci sono basi molecolari per sostenere che il caffè abbia effetti benefici sul fegato. Varie componenti di caffè sono state identificate essere responsabili di effetti benefici,tra cui caffeina, oli di caffè kahweol, kafestol e sostanze antiossidanti provenienti dai chicchi di caffè, ma non c’è un’evidenza definitiva di prove disponibili per nessuna di queste componenti. Dunque gli studi utilizzano modelli animali con danno epatico quale hcc per stabilire se il caffè gioca un ruolo causale nella prevenzione di malattie del fegato e per determinare i suoi meccanismi d’azione. Gli studi prospettici in doppio cieco nei pazienti sono anche incoraggianti. Inoltre numerose interazioni farmacologiche possono verificarsi tra caffeina e droghe neuro attive o tra altre molecole farmacologiche. Pertanto, i pazienti che farmaci contenenti caffeina o che bevono caffè ed assumono droghe che interagiscono con CYP1A2 possono richiedere regolazioni di dosaggio corretto sull’ingestione di caffeina.
BIBLIOGRAFIA
[1] Spiller MA. The chemical components of coffee. In: Spiller GA, editor.
Caffeine. Boca Raton: CRC Press; 1998. p. 97–161.
[2] Willett WC, Stampfer MJ, Manson JE, Colditz GA, Rosner BA, Speizer FE,
et al. Coffee consumption and coronary heart disease in women. A tenyear
follow up. JAMA 1996;275:458–62.
[3] Higdon JV, Frei B. Coffee and health: a review of recent human research.
Crit Rev Food Sci Nutr 2006;46:101–23.
[4] La Vecchia CL. Coffee, liver enzymes, cirrhosis and liver cancer. J Hepatol
2005;42:444–6.
[5] Kono S, Shinchi K, Imanishi K, Todoroki I, Hatsuse K. Coffee and serum
gamma-glutamyltransferase: a study of self defense officials in Japan.
Am J Epidemiol 1994;139:723–7.
[6] Pintus F, Mascia P. Distribution and population determinants of gammaglutamyltransferase
in a random sample of Sardinian inhabitants, “ATSSARDEGNA”
Research Group. Eur J Epidemiol 1996;12:71–3.
[7] Tanaka K, Tokunaga S, Kono S, Tokudome S, Amakatsu T, Moriyama T,
et al. Coffee consumption and decreased serum gamma-glutamyltransferase
and aminotransferase activities among male alcohol drinkers. Int
J Epidemiol 1998;27:438–43.
[8] Honjo S, Kono S, Coleman MP, Shinchi K, Sukurai Y, Todoroki I, et al.
Coffee drinking and serum gamma-glutamyltransferase: an
extended study of Self-Defense Officials of Japan. Ann Epidemiol 1999;9:
325–31.
[9] Honjo S, Kono S, Coleman MP, Shinchi K, Sukurai Y, Todoroki I, et al.
Coffee consumption and serum aminotransferases in middle-aged
Japanese men. J Clin Epidemiol 2001;54:823–9.
[10] Ruhl CE, Jeverhart JE. Coffee and caffeine consumption reduce the risk of
elevated serum alanine aminotransferase activity in the United States.
Gastroenterology 2005;128:24–32.
[11] Friedman SL. Liver fibrosis — from bench to bedside. J Hepatol 2003;38
(Suppl1):S38–53.
[12] Bataller R, Brenner DA. Liver fibrosis. J Clin Invest 2005;115:209–18.
[13] Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in
hepatic fibrosis. Front Biosci 2002;7:d793–807.
[14] Wells RG. Fibrogenesis. V. TGF-beta signaling pathways. Am J Physiol
Gastrointest Liver Physiol 2000;279:G845–50.
Dott.ssa CASTIELLO MARIA ROSARIA
[15] Shi Y, Massague J. Mechanisms of TGF-beta signaling from cell
membrane to the nucleus. Cell 2003;113:685–700.






