Quando uno scienziato decide con grande entusiasmo di scrivere un articolo sulle proteine, in genere, poco dopo realizza con maggiore lucidità che molto probabilmente sarebbe stato meglio pensarne un’altra. Proprio così, perché queste macromolecole biologiche – molecole biologiche con un numero di atomi eccezionalmente elevato – sono davvero difficili da gestire, e allora il rischio è sempre quello di non far passare a pieno la loro reale importanza negli organismi viventi (da quelli unicellulari a quelli pluricellulari) e nei parassiti intracellulari obbligati, come i virus. Il problema è che le proteine non sono solamente tantissime, ma ricoprono anche tantissimi ruoli fondamentali in natura, così quando scegliamo di scomodare queste biomolecole dobbiamo farlo con rispetto e cognizione di causa. Fatta questa breve introduzione sulla grande importanza delle proteine, in questo articolo ci concentreremo sulla composizione chimica e la costruzione di queste macromolecole biologiche.
Le proteine sono una classe di biomolecole (o molecole biologiche) costituite dalla ripetizione di unità che prendono il nome di amminoacidi. Gli amminoacidi sono molecole organiche composte da atomi di carbonio, idrogeno, ossigeno, azoto e in alcuni casi anche di zolfo, come la cisteina e la metionina (Figura). In maggior dettaglio, un atomo di carbonio centrale lega covalentemente un gruppo carbossilico, un atomo di idrogeno, un gruppo amminico e una catena laterale (la glicina è l’unico amminoacido naturale in cui al posto della catena laterale, l’atomo di carbonio centrale lega un altro atomo di idrogeno). Un amminoacido è diverso da un altro sulla base della composizione chimica della catena laterale. Per intenderci, l’atomo di carbonio centrale, il gruppo carbossilico, l’atomo di idrogeno e il gruppo amminico sono costanti in tutti gli amminoacidi; invece, la catena laterale cambia da un amminoacido a un altro. Per esempio, l’acido aspartico e la lisina sono due amminoacidi diversi, e ciò che li rende diversi l’uno dall’altro è proprio la differente composizione chimica della loro catena laterale. Questo è molto importante perché la catena laterale differenzia un amminoacido da un altro non solo dal punto di vista della composizione chimica, ma anche dal punto di vista chimico-fisico, rendendo quindi unico il modo con cui uno specifico amminoacido interagisce in un determinato ambiente. Gli amminoacidi che si ritrovano con maggior frequenza nelle proteine – in natura – sono 20 e vengono classificati considerando la diversa composizione chimica della loro catena laterale, come (esistono diverse classificazioni degli amminoacidi naturali, in questo articolo per comodità verrà fatto riferimento alla seguente): apolari o idrofobici e polari o idrofilici. Fanno parte dei primi la glicina, l’alanina, la valina, la leucina, l’isoleucina, la metionina, la prolina, la fenilalanina e il triptofano. I secondi comprendono invece quelli acidi, come l’acido aspartico e l’acido glutammico; quelli neutri, come la serina, la treonina, la cisteina, l’asparagina, la glutammina e la tirosina; e quelli basici, come la lisina, l’arginina e l’istidina.
A questo punto, cerchiamo di capire come gli amminoacidi costruiscono le proteine. La reazione chimica che permette di legare un amminoacido con un altro – al fine della formazione di una proteina – prende il nome di condensazione. In questo contesto, ogni volta che si verifica una reazione di condensazione, si ha la perdita di una molecola d’acqua e i due amminoacidi (o lo specifico amminoacido della proteina in costruzione con un altro) si legano covalentemente attraverso un legame che si chiama peptidico. In particolare, il legame peptidico si instaura tra l’atomo di carbonio del gruppo carbossilico – legato all’atomo di carbonio centrale – di un amminoacido, e l’atomo di azoto del gruppo amminico – che lega l’atomo di carbonio centrale – di un altro amminoacido. Siccome le proteine sono macromolecole biologiche, il processo che porta alla loro formazione (o sintesi proteica) è caratterizzato da numerose reazioni di condensazione, un’elevata perdita di molecole d’acqua, e un elevato numero di residui amminoacidici legati covalentemente tra di loro attraverso numerosi legami peptidici. Alla fine della sintesi proteica, una proteina sarà di base composta da una estremità carbossi-terminale, in cui il gruppo carbossilico legato all’atomo di carbonio centrale di quell’amminoacido non è impegnato in un legame peptidico; una porzione centrale, in cui il gruppo carbossilico e quello amminico legati all’atomo di carbonio centrale di quegli amminoacidi sono entrambi impegnati in un legame peptidico; e una estremità ammino-terminale, in cui il gruppo amminico legato all’atomo di carbonio centrale di quell’amminoacido non è impegnato in un legame peptidico. L’estremità ammino-terminale rappresenterà la porzione iniziale della proteina, mentre quella carbossi-terminale la sua porzione finale.
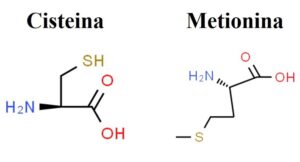
Figura. Formule di struttura dei due amminoacidi naturali solforati: la cisteina (Credit: https://www.chemspider.com/Chemical-Structure.5653.html?rid=ef92bc4a-05d1-46d6-8423-2b262f1da46b) e la metionina (Credit: https://www.chemspider.com/Chemical-Structure.5907.html?rid=1ccfbf9e-fdb1-47b4-ba31-ce53a4474fd2).
Fonti:
Garrett R. H. and Grisham C. M. (2002). Principles of Biochemistry With a Human Focus. Brooks/Cole/Thomson Learning
https://www.scienzintasca.it/a-spasso-nella-biochimica-le-molecole-della-vita/
https://www.scienzintasca.it/la-genetica-e-lespressione-genica/
https://www.chemspider.com/Chemical-Structure.5653.html?rid=ef92bc4a-05d1-46d6-8423-2b262f1da46b
https://www.chemspider.com/Chemical-Structure.5907.html?rid=1ccfbf9e-fdb1-47b4-ba31-ce53a4474fd2
Ringraziamenti:
<a href=’https://www.freepik.com/vectors/background’>Background vector created by freepik – www.freepik.com</a>






